Un equipo de investigación integrado principalmente por especialistas del INTA y de la Fundación Instituto Leloir (FIL) estudió la estructura y función de una proteína del virus que causa el Mal de Río Cuarto (MRCV, por sus siglas en inglés), una de las principales enfermedades que afecta al maíz en la Argentina.
Gracias a este trabajo, los científicos lograron describir por primera vez la estructura de una proteína del virus, contribuyendo este avance a la comprensión de los mecanismos de acción de la replicación viral, esencial para diseñar estrategias biotecnológicas de manejo contra la enfermedad que puede generar enormes pérdidas económicas.
La investigación que fue publicada en la revista internacional mBIO, editada por la Sociedad Estadounidense de Microbiología y publicado en la Argentina por la Agencia CyTA del Instituto Leloir, abre así una puerta importante para diseñar estrategias sanitarias o genéticas para combatir la enfermedad que sólo está presente en la Argentina.
La especialista en virología y biotecnología vegetal Mariana del Vas, junto al grupo de investigadores de la FIL, especializados en el análisis de proteínas, y dirigidos por el biólogo estructural Lisandro Otero, lograron resolver la estructura tridimensional de P9-1.

“Este estudio básico de un patógeno de gran interés agropecuario nos permitirá contribuir al manejo de la enfermedad desde la biotecnología”, afirmó Del Vas.
Maíz, virus y la P9-1
Hace más de 10 años, el equipo de Del Vas, pudo establecer que el MRCV se multiplica en estructuras denominadas “viroplasmas” o fábricas virales que se forman de manera muy temprana, luego de la infección y están constituidas principalmente por una proteína viral denominada P9-1.
Así se ve la proteína P9-1 desde arriba y desde el costado:
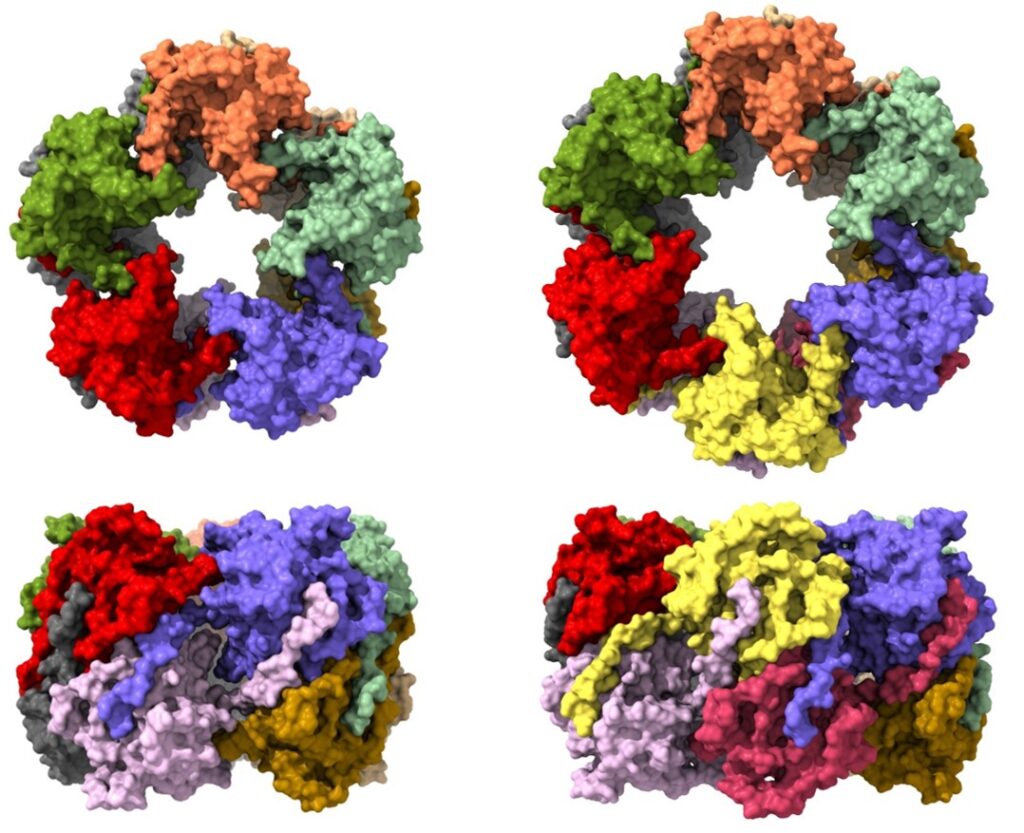
“Logramos determinar con alta precisión la posición que ocupan en el espacio los distintos átomos que conforman a la proteína, lo que hizo posible establecer su estructura tridimensional. De esa manera, pudimos demostrar que adopta dos estados conformacionales en forma de anillo, uno constituido por el arreglo de 10 copias de la proteína (decamérico) y otro por 12 copias (dodecamérico)”, expresó Otero, actual director del Laboratorio de Biología Estructural y Bioinformática del Instituto de Biotecnología Ambiental y Salud (INBIAS-CONICET) de la Universidad Nacional de Río Cuarto, miembro del Centro de Rediseño e Ingeniería de Proteínas (CRIP) de la Universidad Nacional de San Martín y ex integrante del laboratorio de Microbiología e Inmunología que dirige Fernando Goldbaum en la FIL.
“Estos resultados contribuyen a la comprensión del mecanismo de replicación y empaquetamiento de un virus de gran importancia para el maíz en nuestro país y abren nuevas líneas de investigación para seguir profundizando en el tema”, aseguró por su parte Del Vas y agregó: “Por ser un virus que está presente solo en Argentina, necesitamos estudiarlo para poder diseñar estrategias de manejo de la enfermedad”.

















